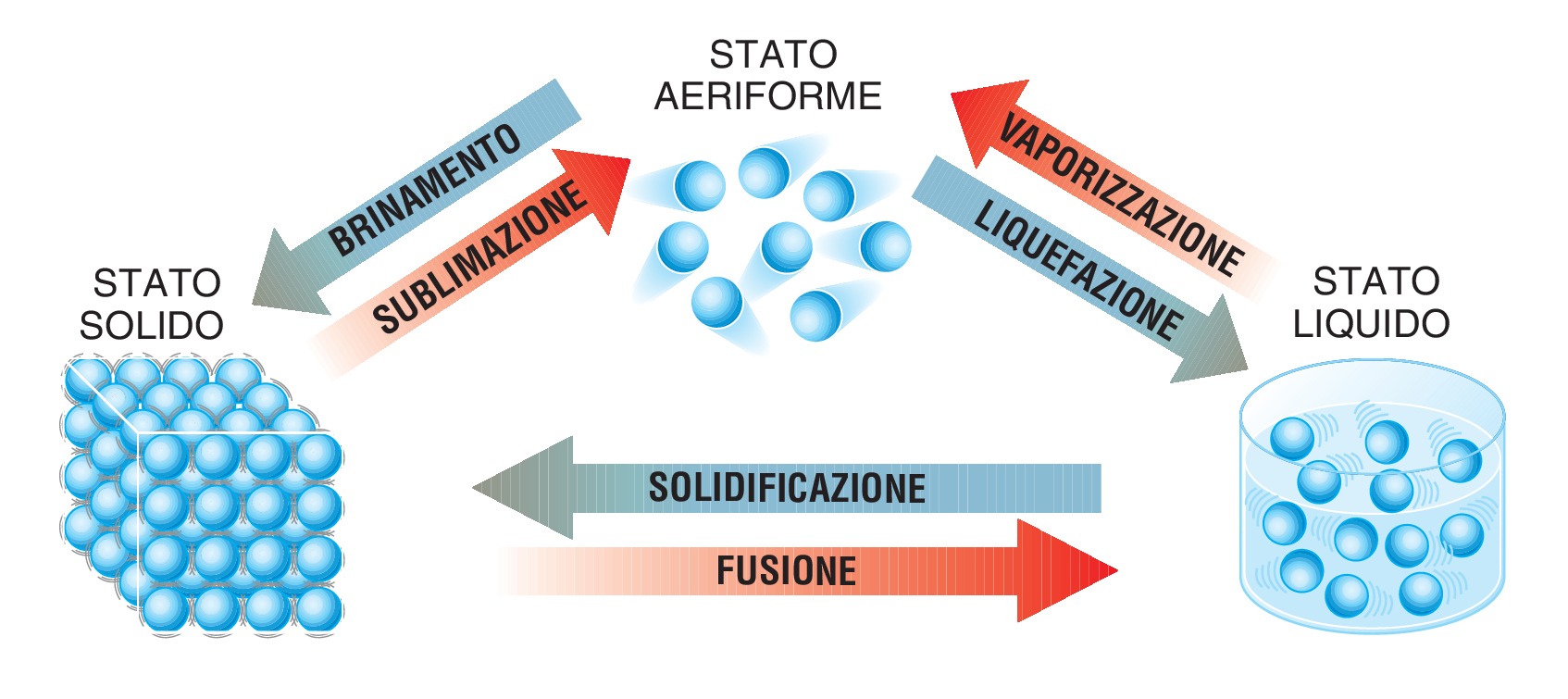
5.4 Da solido ad aeriforme e viceversa
Alcune sostanze passano direttamente dallo stato solido ad aeriforme senza passare attraverso lo stato liquido. Il fenomeno è la sublimazione.
Quali sostanze sublimano?
La naftalina e la canfora un tempo erano molto usate per eliminare le tarme dai cassetti e dagli armadi; si inserivano tra maglioni e cappotti di lana, sotto forma di palline o cubetti che in poco tempo sembravano consumarsi sino a scomparire, lasciando però la traccia del loro odore inconfondibile.
Nei cassetti non si trovava neppure una goccia di liquido, chiaro segno che avveniva la sublimazione. L’anidride carbonica solida, conosciuta come ghiaccio secco, non fonde ma sublima. Il ghiaccio secco è utilizzato per molti scopi; in campo medico e alimentare per mantenere bassa la temperatura, nello spettacolo per produrre un vapore molto scenografico. Il passaggio di stato da gas a solido, senza passare attraverso lo stato liquido, è la sublimazione da gas o brinamento, poiché questo fenomeno è tipico della brina che, a causa delle basse temperature, si forma a partire dal vapore acqueo su terreno e piante. L’anidride carbonica sotto forma gassosa non condensa mai, non diventa cioè liquida, in normali condizioni di pressione dell’aria, ma diventa direttamente solida a -78,5 C°.
per saperne di più
Raffreddare con l’azoto
L’azoto è un gas che costituisce il 78% dell’aria che circonda la Terra, incolore, insapore, inodore. Può passare allo stato liquido se fortemente compresso e può essere conservato in particolari contenitori che lo mantengono isolato dall’ambiente esterno a una temperatura di -196 °C. Se l’azoto liquido viene liberato dal contenitore, torna allo stato di gas assorbendo grandi quantità di calore e facendo così abbassare velocemente la temperatura; per tale motivo è utilizzato come potente refrigerante. L’azoto liquido viene adoperato nell’industria alimentare per surgelare rapidamente i cibi, nelle cucine dei grandi ristoranti per trasformare verdure e carni in modo alternativo alla tradizionale cottura e per la produzione del gelato, e nella ricerca scientifica, se è necessario operare a basse temperature. Un altro campo di utilizzo dell’azoto liquido è la chirurgia dermatologica: attraverso la crioterapia, cioè la cura attraverso il freddo, è possibile trattare alcune malattie della pelle come ad esempio le verruche.